آهن بعد از آلومینیوم، بیشترین فلز موجود در پوسته زمین است. سنگ معدن آهن معمولا به صورت اکسید وجود دارد که با فرآیندهای کاهشی و به کمک کربن (کُک) در دمای بالا و کوره بلند به آهن تبدیل میشود. بیش از 98 درصد از این آهن تولیدی را حتی قبل از سرد شدن به فولاد تبدیل میکنند. مقدار کمی هم در تولید «چدن» (Cast iron) و «فرفورژه» (Wrought Iron) بکار میگیرند. این عنصر که با نماد Fe و با عدد اتمی 26 در گروه هشت از جدول تناوبی عناصر وجود دارد، از گذشته و دوران باستان مورد توجه بوده است. البته تعداد اشیا کشف شده از دوران کهن نسبت به اشیا ساخته شده با طلا یا نقره کمتر است چراکه این فلز بیشتر دچار خوردگی میشود.
در سال 1774، شیمیدان فرانسوی، آنتوان لاوازیه از واکنش بخار آب با آهن در داخل یک لامپ آهنی برای تولید هیدروژن استفاده کرد. این آزمایش سبب اثبات پایستگی جرم و تبدیل علم شیمی از یک دانش کیفی به یک دانش کمی شد.
موارد استفاده از آهن
همانطور که گفته شد، مقادیر کمی از این فلز در ساخت چدن بکار میرود. چدن در حدود 92 درصد از آهن خالص ساخته شده است. مابقی در حدود ۲-5 درصد کربن، ۱-3 درصد سیلیکون و مقادیری منگنز، فسفر و گوگرد را تشکیل میدهند. در گذشته از آن در رادیاتورهای حرارتی، اجاقهای قدیمی، پوشش سقفها، موانع و چراغهای شهری استفاده میشد. البته به علت شکنندگی و تمایل آن به خوردگی، چدن با دیگر مواد جایگزین شد.
فرفورژه (گلنرده) حاوی کمتر از 0/15 درصد کربن است که به کمک فرآیند کاهش سنگ آهن در حالت جامد بدست میآید. از آنجایی که فرفوژه قابلیت چکشخواری و خم شدن داشت، از آن در طراحی نردهها، دروازهها، مبلمان باغهای قدیمی و محصولات دکوری دیگر استفاده میشد. امروزه از فولاد در تهیه این نوع از محصولات استفاده میشود.
آهن، بیشترین استفاده را در میان فلزات دارد و بیش از 90 درصد فلزات تولیدی در جهان را شامل میشود. قیمت کم و مقاومت بالای آن از عوامل رونق آن بوده است. این فلز در ساخت ابزارآلات، ریلهای راهآهن، خودروها، میلگرد و بسیاری سازههای جادهای کاربرد دارد. از آنجایی که آهن خالص همانند طلا نرم است، معمولا آن را به صوت آلیاژی از عناصر مختلف بکار میبرند.
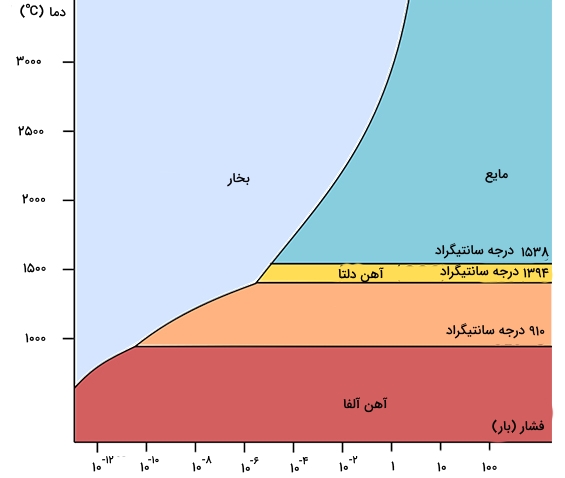
آلوتروپها و خواص فیزیکی و شیمیایی آهن
حداقل چهار آلوتروپ از این فلز با نمادهای αα، γγ، δδ و εε شناخته شده است. آلوتروپهای آلفا، گاما و دلتا در فشار معمول حضور دارند. خواص فیزیکی آهن در فشارهای بسیار زیاد نیز مورد مطالعه قرار گرفته است. در فشار 10GPa10GPa، آهن آلفا به آلوتروپ آهن «اپسیلون» (ε)(ε) تبدیل میشود.
خواص مغناطیسی آهن
پایینتر از «نقطه کوری» (Curie Point)، یعنی کمتر از 770 درجه سانتیگراد، آهن آلفا از حالت پارامغناطیس به فرومغناطیس تغییر میکند. اسپین دو الکترون جفتنشده در هر اتم با اسپین اتمهای مجاور همتراز و سبب ایجاد یک میدان مغناطیسی میشوند. در غیاب یک منبع خارجی میدان مغناطیسی، اتمها به طور خود به خودی در «دامنههای مغناطیسی» (Magnetic Domain) با فاصله معین ده میکرومتری از هم قرار میگیرند به گونهای که اتمها در هر دامنه مغناطیسی، اسپین موازی دارند، اما دامنههای مختلف، اسپین متفاوتی خواهند داشت به همین دلیل، قطعهای از آهن، میدان مغناطیسی ندارد.
ترکیبات شیمیایی آهن
آهن خواصی همچون فلزات واسطه از خود نشان میدهد به این معنی که اعداد اکسایش متفاوتی دارد. آرایش الکترونی آهن به صورت زیر است:
[Ar]3d64s2[Ar]3d64s2
در این آرایش، اوربیتالهای 3d3d و 4s4s از لحاظ انرژی به یکدیگر بسیار نزدیک هستند و در نتیجه برای رسیدن به پایداری گاز نجیب قبل خود، تعداد متفاوتی الکترون از دست میدهند. البته در بیشتر موارد، این فلز ترکیباتی با عدد اکسایش +2+2 و +3+3 تشکیل میدهد که به ترتیب به نامهای آهن (II) و آهن (III) موسوماند.
برخلاف دیگر فلزات، آهن با جیوه تشکیل آمالگام (ملغمه) نمیدهد. در نتیجه، برای نگهداری و فروش جیوه، استفاده از ظروف آهنی مرسوم است.
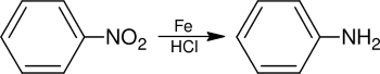
اگرچه از این فلز بیشتر در مهندسی مواد استفاده میشود اما ترکیبات آن در صنایع دیگر نیز مورد استفاده قرار میگیرند. به عنوان مثال از کاتالیزورهای آهنی در فرآیند هابر و تولید آمونیاک استفاده میشود. همچنین از این فلز در «فرآیند فیشر-تروپش» (Fischer-Tropsch Process) برای تبدیل مونواکسید کربن به سوختهای هیدروکربنی بهره میگیرند. پودر آهن در یک محلول اسیدی در کاهش نیتروبنزن به آنیلین کاربرد دارد. تصویر زیر که به فرآیند «کاهش بشان» (Bechamp Reduction) موسوم است حالت کلی تبدیل ترکیبات نیتروژنی آروماتیک را به آنیلین نشان میدهد:
اکسیدها و هیدروکسیدهای آهن
این فلز ترکیبات متفاوتی از اکسید و هیدروکسید تشکیل میدهد. معمولترین نوع این ترکیبات، اکسید آهن (II و III) با فرمول Fe3O4Fe3O4 و آهن (III) اکسید با فرمول Fe2O3Fe2O3 است. البته آهن (II) اکسید هم وجود دارد که در دمای اتاق پایدار نیست. معروفترین سولفید آهن با نام «پیریت» (FeS2)(FeS2) شناخته میشود که جلای طلایی رنگ دارد و در متون فارسی به آن مارقشیشا میگویند. این ماده یک ترکیب با آهن (IV) نیست بلکه درواقع یک آهن (II) پلیسولفید حاوی یونهای Fe2+Fe2+ و S22−S22− در یک «ساختار آشفته» (Distorted Structure) است.





















